Page 23 - Zmist-n4-2015
P. 23
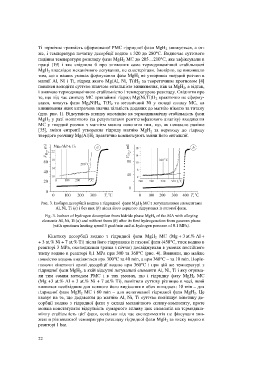
Ti термічна тривкість сформованої РМС гідридної фази MgH 2 знижується, а от-
же, і температура початку десорбції водню з 320 до 280°С. Водночас суттєвого
падіння температури розкладу фази MgH 2 МС до 205…210°С, яке зафіксували в
праці [19] і яке свідчило б про зниження саме термодинамічної стабільності
MgH 2 внаслідок механічного легування, не спостерігали. Імовірно, це викликано
тим, що в наших умовах формування фази MgH 2 не утворився твердий розчин в
магнії Al, Ni і Ti, гідрид якого Mg(Al, Ni, Ti)H 2 за теоретичним прогнозом [4]
повинен володіти суттєво нижчою ентальпією виникнення, ніж за MgH 2, а відтак,
і нижчою термодинамічною стабільністю і температурою розкладу. Свідчити про
те, що під час синтезу МС принаймні гідрид Mg(Ni,Ti)H 2 практично не сформу-
вався, можуть фази Mg 2NiH 4, ТіН 2 та металічний Ni у складі сплаву МС, на
виникнення яких витрачена значна кількість доданих до магнію нікелю та титану
(див. рис. 1). Відсутність впливу алюмінію на термодинамічну стабільність фази
MgH 2 у разі можливого (за результатами рентгенофазового аналізу) входження
МС у твердий розчин з магнієм можна пояснити тим, що, як показано раніше
[35], зміни ентропії утворення гідриду магнію MgH 2 за переходу до гідриду
твердого розчину Mg(Al)H 2 практично компенсують зміни його ентальпії.
Рис. 3. Iзобари десорбції водню з гідридної фази MgH 2 МС з легувальними елементами
Al, Ni, Ti (а) і без них (b) після його першого гідрування із газової фази.
Fig. 3. Isobars of hydrogen desorption from hidride phase MgH 2 of the MA with alloying
elements Al, Ni, Ti (а) and without them (b) after its first hydrogenation from gaseous phase
(with specimen heating speed 3 grad/min and at hydrogen pressure of 0.1 MPa).
Кінетику десорбції водню з гідридної фази MgH 2 МС (Mg + 3 at.% Al +
+ 3 at.% Ni + 7 at.% Ti) після його гідрування із газової фази (450°С, тиск водню в
реакторі 3 МРа, охолодження зразка з піччю) досліджували в умовах постійного
тиску водню в реакторі 0,1 МРа при 300 та 360°С (рис. 4). Виявили, що майже
повністю водень виділяється при 300°C за 40 min, а при 360°C – за 10 min. Порів-
нюючи кінетичні криві десорбції водню при 360°С і при цій же температурі з
гідридної фази MgH 2, в якій відсутні легувальні елементи Al, Ni, Tі і яку отрима-
ли тим самим методом РМС і в тих умовах, що і гідридну фазу MgH 2 МС
(Mg +3 at.% Al + 3 at.% Ni + 7 at.% Ti), помітили суттєву різницю в часі, який
виявився необхідним для повного його виділення в обох випадках: 10 min – для
гідридної фази MgH 2 МС і 60 min – для нелегованої гідридної фази MgH 2. Це
вказує на те, що додавання до магнію Al, Ni, Ti суттєво поліпшує кінетику де-
сорбції водню з гідридної фази у складі механічного сплаву-композиту, проте
можна констатувати відсутність сумарного впливу цих елементів на термодина-
мічну стабільність цієї фази, оскільки під час експериментів не фіксували зни-
ження рівноважної температури розкладу гідридної фази MgH 2 за тиску водню в
реакторі 1 bar.
22