Page 24 - Zmist-n4-2015
P. 24
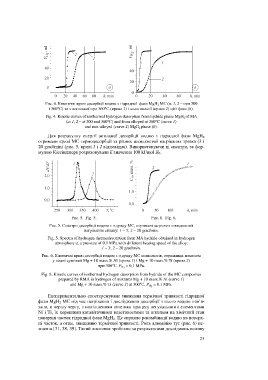
Рис. 4. Кінетичні криві десорбції водню з гідридної фази MgH 2 МС (а: 1, 2 – при 300
і 360°С) та з легованої при 360°С (крива 1) i нелегованої (крива 2) цієї фази (b).
Fig. 4. Kinetic curves of isothermal hydrogen desorption from hydride phase MgH 2 of MA
(a: 1, 2 – at 300 and 360°С) and from alloyed at 360°C (curve 1)
and non-alloyed (curve 2) MgH 2 phase (b).
Для розрахунку енергії активації десорбції водню з гідридної фази MgH 2
отримали криві МС термодесорбції за різних швидкостей нагрівання зразка (3 і
20 grad/min) (рис. 5, криві 1 і 2 відповідно). Використовуючи ці спектри, за фор-
мулою Кіссінджера розраховували її значення 100 kJ/mol Н 2.
Рис. 5. Fig. 5. Рис. 6. Fig. 6.
Рис. 5. Спектри десорбції водню з гідриду МС, отримані за різних швидкостей
нагрівання сплаву: 1 – 3; 2 – 20 grad/min.
Fig. 5. Spectra of hydrogen thermodesorption from MA hydride obtained in hydrogen
atmosphere at a pressure of 0.1 MPa with different heating speed of the alloy:
1 – 3; 2 – 20 grad/min.
Рис. 6. Кінетичні криві десорбції водню з гідриду МС композитів, отриманих помелом
у водні сумішей Mg + 10 mass.% Al (крива 1) і Mg + 10 mass.% Ti (крива 2)
= 0,1 MPa.
при 300°С. P H 2
Fig. 6. Kinetic curves of isothermal hydrogen desorption from hydride of the MC composites
prepared by RMА in hydrogen of mixtures Mg + 10 mаss.% Al (curve 1)
= 0.1 MPa.
and Mg + 10 mass.% Ti (curve 2) at 300°С. P H 2
Експериментально спостережуване зниження термічної тривкості гідридної
фази MgH 2 МС під час нагрівання і дослідження десорбції з нього водню пов’я-
зано, в першу чергу, з поліпшенням кінетики процесу легувальними елементами
Ni і Ti, їх хорошими каталітичними властивостями та впливом на хімічний стан
поверхні часток гідридної фази MgH 2. Це сприяло рекомбінації водню на поверх-
ні часток, а отже, зниженню термічної тривкості. Роль алюмінію тут (рис. 6) не-
значна [31, 38, 39]. Такий висновок зроблено за результатами досліджень впливу
23