Page 124 - Zmist-n3-2015-new
P. 124
фосфатної кислоти різної концентрації корелює з корозійною поведінкою порош-
ку титану: потенціал електрода в 10%-й кислоті знаходиться в зоні пасивності, а
в 52- та 78%-их її розчинах через 40...50 h досягає області активного розчинення.
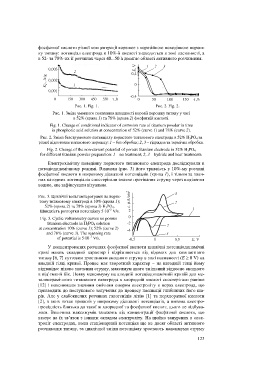
Рис. 1. Fig. 1. Рис. 2. Fig. 2.
Рис. 1. Зміна умовного показника швидкості корозії порошку титану у часі
в 52% (крива 1) та 78% (крива 2) фосфатній кислоті.
Fig. 1. Change of conditional indicator of corrosion rate of titanium powder in time
in phosphoric acid solution at concentration of 52% (curve 1) and 78% (curve 2).
Рис. 2. Зміна безструмового потенціалу пористого титанового електрода в 52% H 3 PO 4 за
різної підготовки титанового порошку: 1 – без обробки; 2, 3 – гідридна та термічна обробки.
Fig. 2. Change of the non-current potential of porous titanium electrode in 52% H 3 PO 4
for different titanium powder preparation: 1 – no treatment; 2, 3 – hydride and heat treatments.
Електрохімічну поведінку пористого титанового електрода досліджували в
потеціодинамічному режимі. Виявили (рис. 3) його тривкість у 10%-му розчині
фосфатної кислоти в широкому діапазоні потенціалів (крива 1), і тільки за знач-
них катодних потенціалів спостерігали значне протікання струму через виділення
водню, яке зафіксували візуально.
Рис. 3. Циклічні вольтамперограми на порис-
тому титановому електроді в 10% (крива 1);
52% (крива 2) та 78% (крива 3) Н 3 РО 4 .
–3
Швидкість розгортки потенціалу 5·10 V/s.
Fig. 3. Cyclic voltammetry curves on porous
titanium electrode in H 3 PO 4 solution
at concentration 10% (curve 1); 52% (curve 2)
and 78% (curve 3). The scanning rate
–3
of potential is 5·10 V/s.
У концентрованих розчинах фосфатної кислоти циклічні потенціодинамічні
криві мають складний характер і відрізняються від відомих для компактного
титану [6, 7] суттєвим зростанням анодного струму в зоні пасивності (Е ≥ 0 V) на
анодній гілці кривої. Процес має зворотний характер – на катодній гілці йому
відповідає пікове значення струму, максимум якого зміщений відносно анодного
в від’ємний бік. Появу максимуму на анодній потеціодинамічній кривій для ме-
талокерамічного титанового електрода в хлоридній кислоті спостерігали раніше
[12] і пояснювали значним омічним опором електроліту в порах електрода, що
призводить до поступового залучення до процесу пасивації глибинних його ша-
рів. Але у слабокислих розчинах галогенідів літію [1] та перхлоратної кислоти
[2], в яких титан тривкий у широкому діапазоні потенціалів, а питома електро-
провідність близька до такої ж хлоридної та фосфатної кислот, цього не відбува-
лося. Величина максимумів залежить від концентрації фосфатної кислоти, що
вказує на їх зв’язок з іонним складом електроліту. На щойно занурених в елек-
троліт електродах, коли стаціонарний потенціал ще не досяг області активного
розчинення титану, за циклічної зміни потенціалу зростають максимуми струму
123