Page 119 - Zmist-n5-2015
P. 119
довищах до 5-го циклу. За подальших циклів розвивається активне окиснення
поверхні.
Враховуючи переважаючий вміст заліза у досліджуваному сплаві, його роз-
чинення, очевидно, відбувається з нагромадженням в приелектродному шарі
2+ 0
достатньої кількості іонів Fe , які каталізують одноелектронне окиснення Fe на
+
поверхні АМС-електрода до іонів Fe , що існують тільки у адсорбованому стані
[12]. Різке підвищення струмів проявляється за взаємодії іонів заліза з водним роз-
–
чином у присутності іонів Сl . У результаті таких поверхневих перетворень вини-
кають сполуки вищого ступеня окиснення Fe, які мають захисні властивості. Важ-
корозчинний гідроксид Fe(ОН) 3 аds гальмує іонний обмін на межі АМС-електрод–
розчин. Всі ці процеси характеризуються високим ступенем рівноважності [12].
Розширення використання аморфного сплаву [13] передбачає його роботу в
агресивних середовищах за підвищених температур. Збільшення температури
–
корозивного середовища прискорює дифузійний рух йонів ОН до межі розчин–
електрод, що однозначно сприяє їх концентруванню на металевій поверхні.
Окиснення поверхні електрода внаслідок електрохімічної реакції зумовлює
також за умови достатньої адгезії формування окисно-гідроксидних захисних ша-
рів, під якими відбувається пасивація металевої поверхні. Однак підвищення тем-
–
ператури середовища також може викликати за надлишкової кількості ОН йонів
локальне розчинення нерозчинних оксидів внаслідок перетворення їх у розчинні
гідроксосполуки. Тоді протикорозійна тривкість АМС-електродів знижується, що
зумовлює приріст струмів корозії за малих відхилень потенціалів корозії.
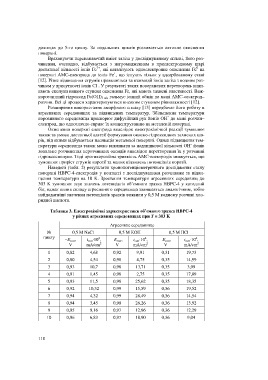
Наведені (табл. 2) результати хронопотенціометричного дослідження стану
поверхні HВPC-4-електродів у контакті з досліджуваними розчинами за підви-
щення температури на 10 K. Зростання температури агресивних середовищ до
303 K зумовлює зсув значень потенціалів об’ємного зразка HВPC-4 у катодний
бік, однак вплив складу агресивного середовища залишається аналогічним, тобто
найдодатніші значення потенціалів зразків виявили у 0,5 М водному розчині хло-
ридної кислоти.
Таблиця 3. Електрохімічні характеристики об’ємного зразка HВPC-4
у різних агресивних середовищах при Т = 303 K
Агресивне середовище
№ 0,5 М NaCl 0,5 M KOH 0,5 М HCl
циклу 4 4 4
–Е corr , i corr ·10 , –Е corr , і corr ·10 , –E corr , і corr ·10 ,
2 2 2
V mА/сm V mА/сm V mА/сm
1 0,82 4,68 0,92 9,91 0,31 19,73
2 0,80 4,54 0,98 4,75 0,35 14,99
3 0,93 10,7 0,98 13,71 0,35 3,99
4 0,91 1,45 0,98 2,75 0,35 17,89
5 0,93 11,5 0,98 25,62 0,35 18,35
6 0,92 10,32 0,99 15,59 0,36 19,52
7 0,94 4,32 0,99 28,49 0,36 14,54
8 0,94 3,45 0,98 26,26 0,36 13,92
9 0,95 9,16 0,97 12,96 0,36 12,29
10 0,96 6,83 0,97 18,90 0,36 9,04
118